Uno studio di genomica apparso su Nature Ecology & Evolution ha attirato l’attenzione sul Chaenocephalus aceratus, un bizzarro pesce che nuota nelle gelide acque al largo delle coste dell’Antartide. Questi pesci hanno evoluto fenotipi adattati al freddo mentre l’Oceano Antartico si raffreddava a temperature sotto lo zero, sono privi di globuli rossi e di pigmenti dell’emoglobina per il trasporto di ossigeno.
Un’affinità per l’ossigeno – un successo evolutivo
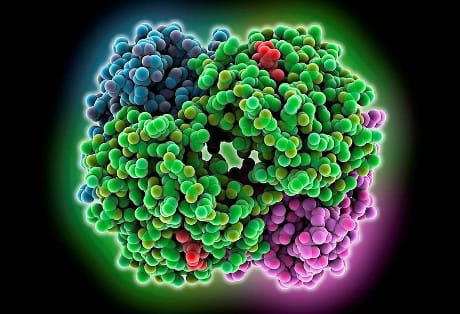
Emoglobina – Ciascuna delle quattro sub-unità dell’emoglobina può trasportare una molecola di ossigeno
Il segreto del successo dell’emoglobina nell’evoluzione è la sua alta efficienza nel raccogliere l’ossigeno dove è abbondante (come all’aria aperta e nei polmoni) per poi rilasciarlo gradualmente nei tessuti affamati di ossigeno, tutto questo grazie ad un legame estremamente collaborativo: quando il pigmento lega una molecola di ossigeno, può legarsi ancora più facilmente alla molecola successiva, fino a quando tutti e quattro i posti vacanti sono riempiti.
Ma per quanto buona, l’emoglobina non è la molecola ideale per trasportare ossigeno in tutte le circostanze. L’efficienza dell’emoglobina diminuisce con la temperatura; lo svantaggio del legame collaborativo dell’emoglobina è che funziona peggio quando la disponibilità di ossigeno è ridotta, come per esempio negli ambienti artici.
Osservando il genoma del Chaenocephalus aceratus, una specie di pesce ghiaccio, i ricercatori sono riusciti a osservare gli adattamenti evolutivi che gli hanno permesso di sopravvivere. Alcuni erano comuni ai pesci a sangue rosso che vivono nelle acque antartiche, con la presenza di geni supplementari per la produzione di proteine del sangue “antigelo”. Altri erano legati alla totale mancanza di globuli rossi, con altri accorgimenti come l’aumento di enzimi che proteggono i tessuti dall’ossigeno libero altamente reattivo presente nel sangue.
Alcune creature che vivono sopra o vicino al freddo fondale dell’oceano, utilizzano al posto dell’emoglobina l’emocianina una metalproteina respiratoria meno efficiente dell’emoglobina nel catturare l’ossigeno.
Nonostante le funzioni respiratorie dell’emocianina siano simili a quelle dell’emoglobina, ci sono alcune differenze nella sua struttura molecolare e nel meccanismo di funzionamento. L’ossigenazione dell’emocianina causa un cambiamento di colore tra la forma deossigenata, non colorata, alla forma ossigenata, colorata in blu.

I globuli rossi umani sono particolarmente ottimizzati per il lavoro di distribuzione dell’ossigeno. Sono compatti, flessibili e hanno una forma a disco biconcavo che li aiuta a scivolare attraverso gli stretti capillari e al tempo stesso dà loro un ottimo rapporto volume-superficie, in modo da contenere molta emoglobina e ossigeno.
Gli eritrociti umani fanno un passo avanti rispetto a quelli della maggior parte delle specie, espellendo il nucleo e altri organelli dopo aver accumulato tutte le proteine di cui avranno bisogno per conservarsi in vita: quello che rimane è fondamentalmente un sacchetto di emoglobina. Ma le cellule pagano una penale per questo snellimento: a causa della loro limitata capacità di riparare l’usura dei capillari, i globuli rossi umani in circolo hanno una durata di vita di soli 120 giorni.
Quando i globuli rossi muoiono, il corpo converte l’emoglobina in composti meno tossici, fra cui il pigmento verde biliverdina, infatti il colore verde di un livido in via di guarigione è dovuto alla biliverdina.
Fonti:
https://www.lescienze.it/news/2019/04/27/news/pesce_sangue_bianco_varianti_emoglobina-4383388/





